E então levando em consideração as leis de
conservação de massa de Lavoisier e das proporções definidas de Proust,
elaborou a lei de proporções multiplas que diziam:
“Quando
dois elementos se combinam para formar mais de um composto, se a massa de um
deles permanecer constante, a do outro vai variar numa relação de números
inteiros e pequenos.”
No entanto a sua proposição estava errada ao
estabelecer que o composto mais simples formado entre dois elementos A e B
seriam o de proporção 1:1. Isso
acontecia porque ele acreditava que os gases eram formando por um único átomo,
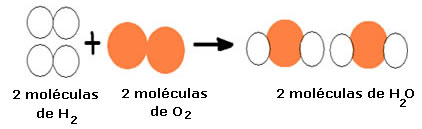
como H, Cl, O e não H2, Cl2, O2. Assim
teríamos a molécula da água como HO e não H2O, NH e não NH3.
Até esse momento, ainda não existiam os
conceitos de mol, peso molecular e peso atomico, então Dalton não conseguia
medir o peso do átomo de cada elemento com precisão, por isso para ele a
molécula mais simples de uma substancia tinha um átomo de cada elemento.
Embora Lavoisier, Proust e outros cientistas da época tivessem
dados experimentais a respeito do comportamento da matéria, esses dados experimentais
não eram capazes de responder questões como:
-Porque um composto apresenta sempre a mesma composição em massa?
-Porque que o numero de elementos conhecidos são reduzidos, e o
numero de compostos chegava a milhares?
Nesse momento as respostas parecem fáceis de responder, no entanto
como seria possível descrever o comportamento de uma amostra de tamanho
insignificante de matéria, sem que pudesse vê-la ou tocá-la, e que
justificasse, nesse nível, o comportamento macroscópico verificado pelos
cientistas da época
Para explicar essas perguntas em nível microscópico, foi
desenvolvida, entre 1803 e 1808, por John Dalton, uma teoria atômica, também
conhecida como modelo da bola de bilhar:
 |
2.
Existe um número
finito de tipos de átomos na natureza.
3.
As combinações de
iguais ou diferentes tipos de átomos originam os
diferentes materiais.
Na época de Dalton, 36 elementos químicos haviam sido isolados e
ainda utilizavam simbologia da alquimia para representar tais elementos
químicos. A novidade de Dalton foi combinar os símbolos para formar a formula
estrutural dos compostos. A figura mostra os vários átomos e moléculas em "Um novo sistema de filosofia quíimica".
Referências
- Canto, E. L.; Peruzzo, F. M. (2003a). Química na abordagem do cotidiano: Química geral e inorganica. São Paulo: Moderna.
- Russel, J.B. Química geral. Trad. M. Guekezian et. al. São Paulo: Mokron Books, 1994. v.1.
- Atkins, P.; Loretta, J. Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente. 2 ed. Porto Alegre: Bookman, 2001.


que podre
ResponderExcluirpra carai